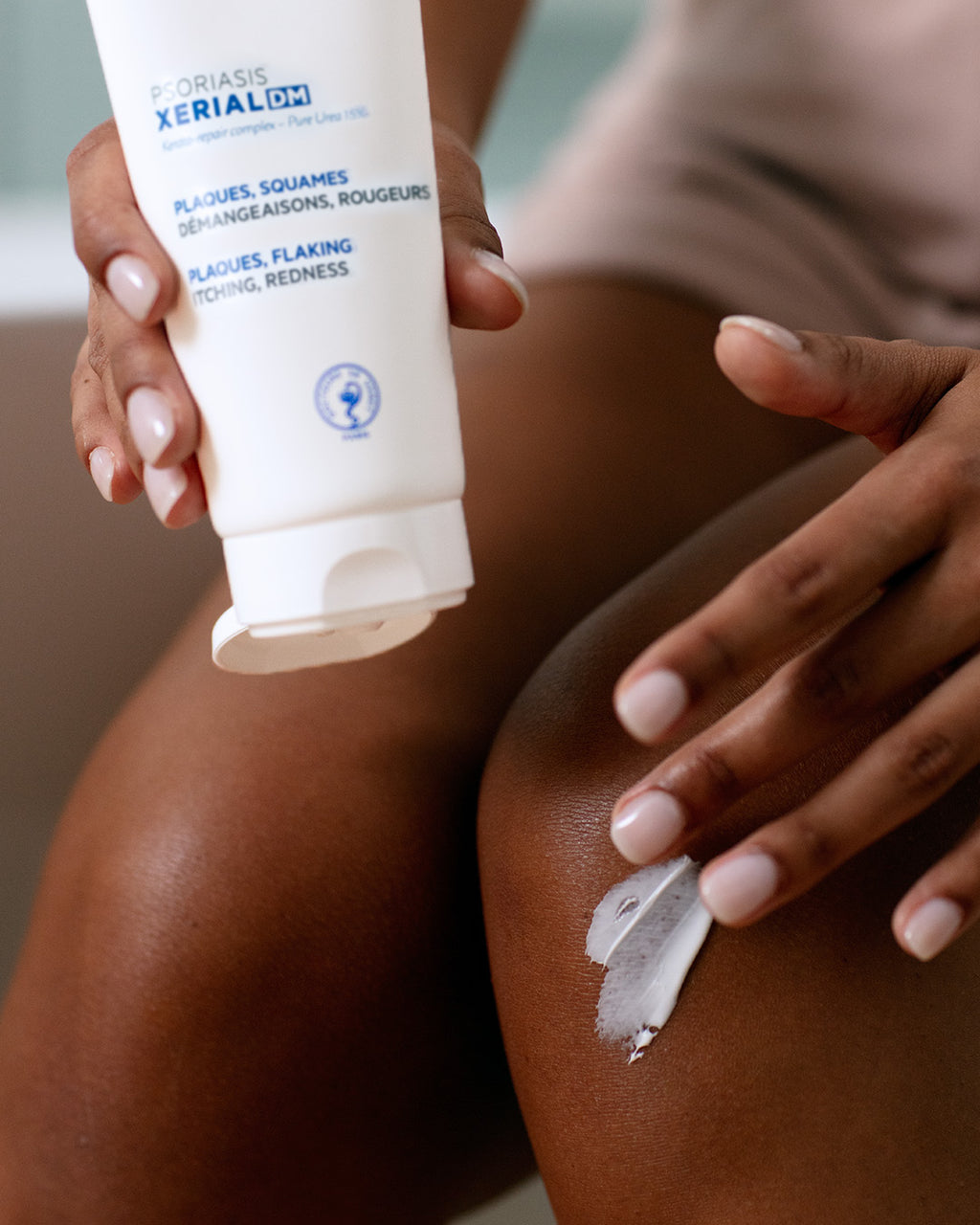




BEWEZEN RESULTATEN
VANAF 14 DAGEN
• -27% schilfers2
NA 30 DAGEN
• -23% minder roodheid2
• +19% plaqueverbetering (PSI totaalscore)2
• 96% van de patiënten vond de laagvormende textuur gemakkelijk aan te brengen3
1- Mammone, T.; Gan, D.; Fthenakis, C.; Marenus, K. The Effect of N-Acetyl-Glucosamine on Stratum Corneum Desquamation and Water Content in Human Skin. J. Cosmet. Sci. 2009, 60, 423–428.
2- Multicentrisch (centrum 1 inactief), gerandomiseerd, dubbelblind, placebogecontroleerd klinisch onderzoek bij 30 patiënten met 2 psoriasisplaques (≈ 20 cm², ten minste 15 cm van elkaar), in twee afzonderlijke fasen met toepassing van XERIAL DM Psoriasis of placebo tweemaal daags op de psoriasisplaques gedurende 30 dagen voor fase 1 en gedurende 28 dagen voor fase 2, gescheiden door behandeling met calcipotriol en betametason (een dermocorticoïde). Klinisch evaluatierapport van 09-11-2021 nr. 03-DM-2018 - nr. ID-RCB 2018-A03297-48. Evaluatie van PSI-totaalscore en subscores voor afschilfering en ruwheid na 14 en 30 dagen (fase 1): PSI: n=30, gemiddelde (D0) = 7,50±1,22, gemiddelde (D14)=6,10±1,75 (p <0,001); significant verschil t.o.v. placebo; afschilfering n=30, gemiddelde (D0) = 2,57±0,61, gemiddelde (D14): 1,87±0,90 (p <0.001), significant verschil t.o.v. placebo; Roodheid n=30, gemiddelde (D0) = 2,60±0,50, gemiddelde (D30): 2,00±0,79 (p <0,001), significant verschil t.o.v. placebo. Veiligheidsresultaten: 42,4% van de patiënten ondervond in totaal 24 lichte tot matige bijwerkingen, waarvan er 13 mogelijk verband hielden met de studieproducten: 9 met XERIAL DM PSORIASIS en 4 met PLACEBO. Deze effecten zijn: tintelingen (9%), pruritus (15%) en branderig gevoel (3%). Alle gerelateerde bijwerkingen waren lokaal en verdwenen voor het einde van het onderzoek.
3- Multicentrisch (centrum 1 inactief), gerandomiseerd, dubbelblind, placebogecontroleerd klinisch onderzoek bij 30 patiënten met 2 psoriasisplaques (≈ 20 cm², ten minste 15 cm uit elkaar), in twee afzonderlijke fasen met toepassing van XERIAL DM Psoriasis of placebo tweemaal daags op de psoriasisplaques gedurende 30 dagen voor fase 1 en gedurende 28 dagen voor fase 2, gescheiden door behandeling met calcipotriol en betametason (een dermocorticoïde). Klinisch evaluatierapport gedateerd 09-11-2021 n° 03-DM-2018 - n° ID-RCB 2018-A03297-48 . Zelfevaluatie na 7 dagen (fase 2).
4- France Psoriasis.