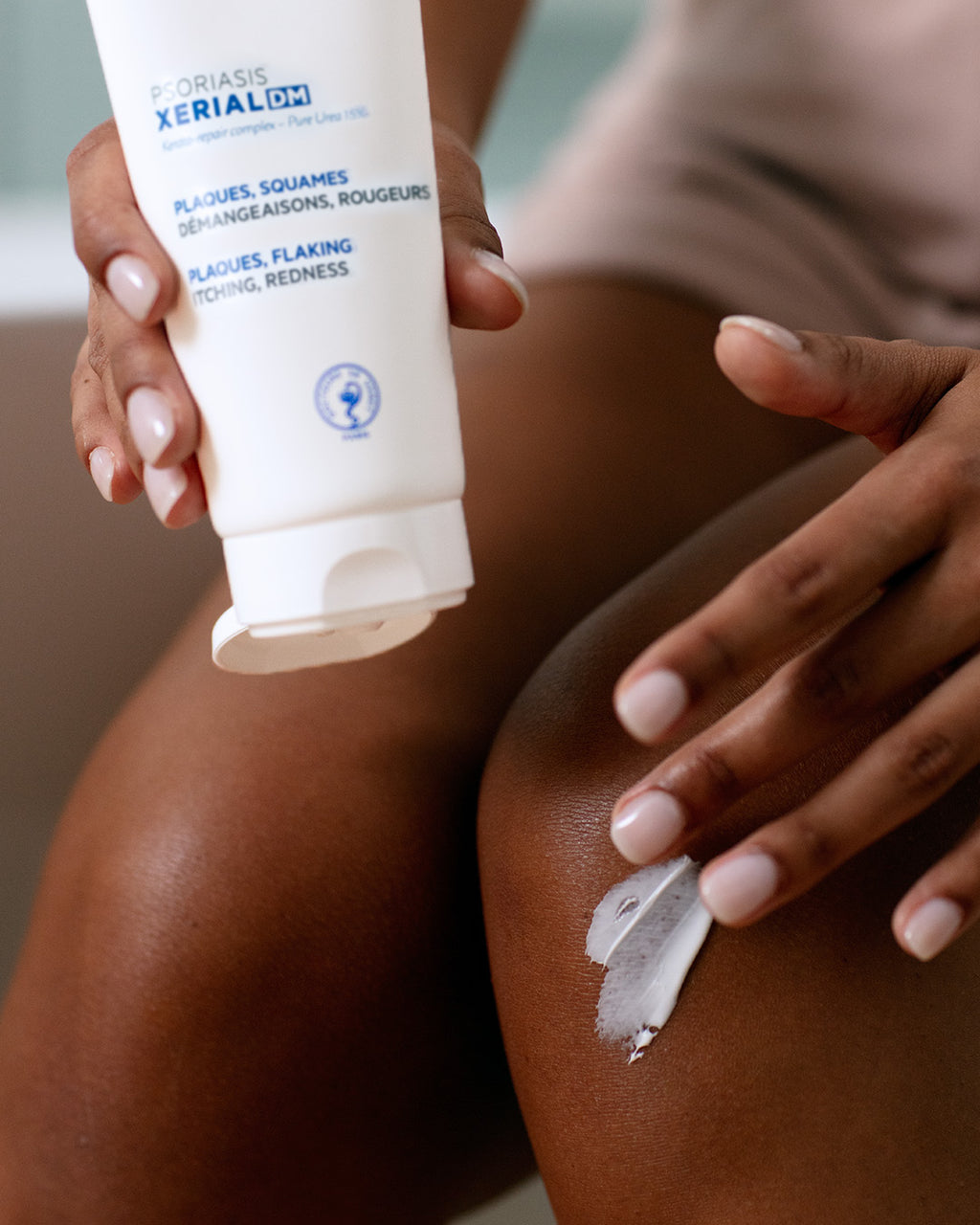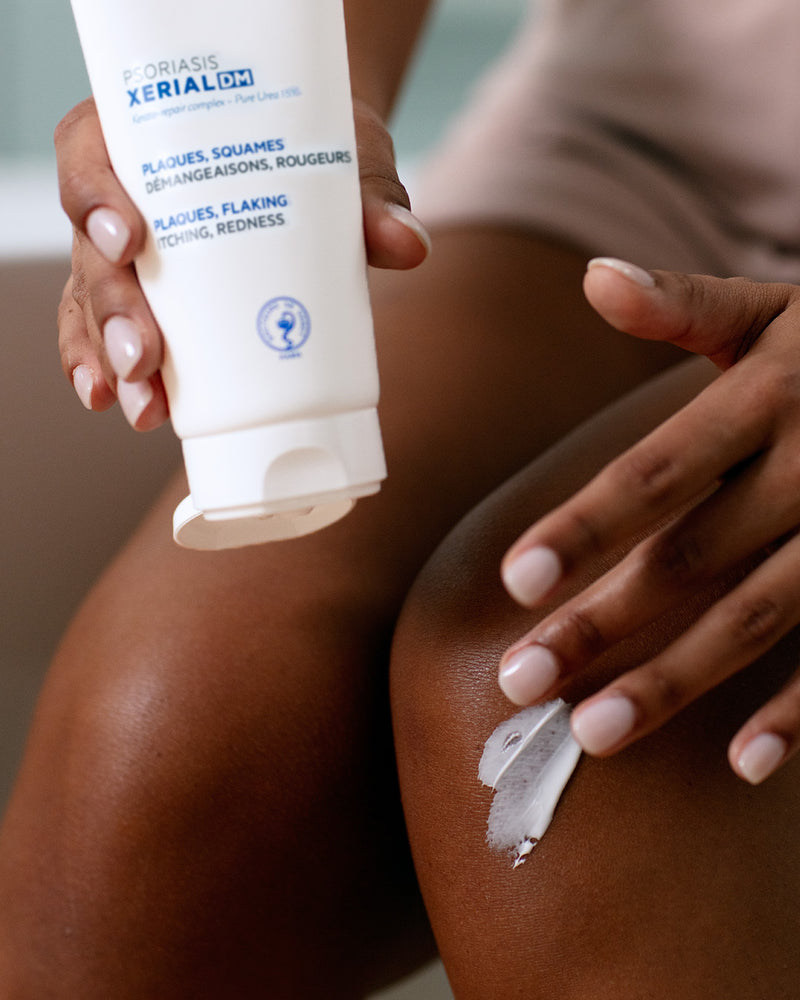



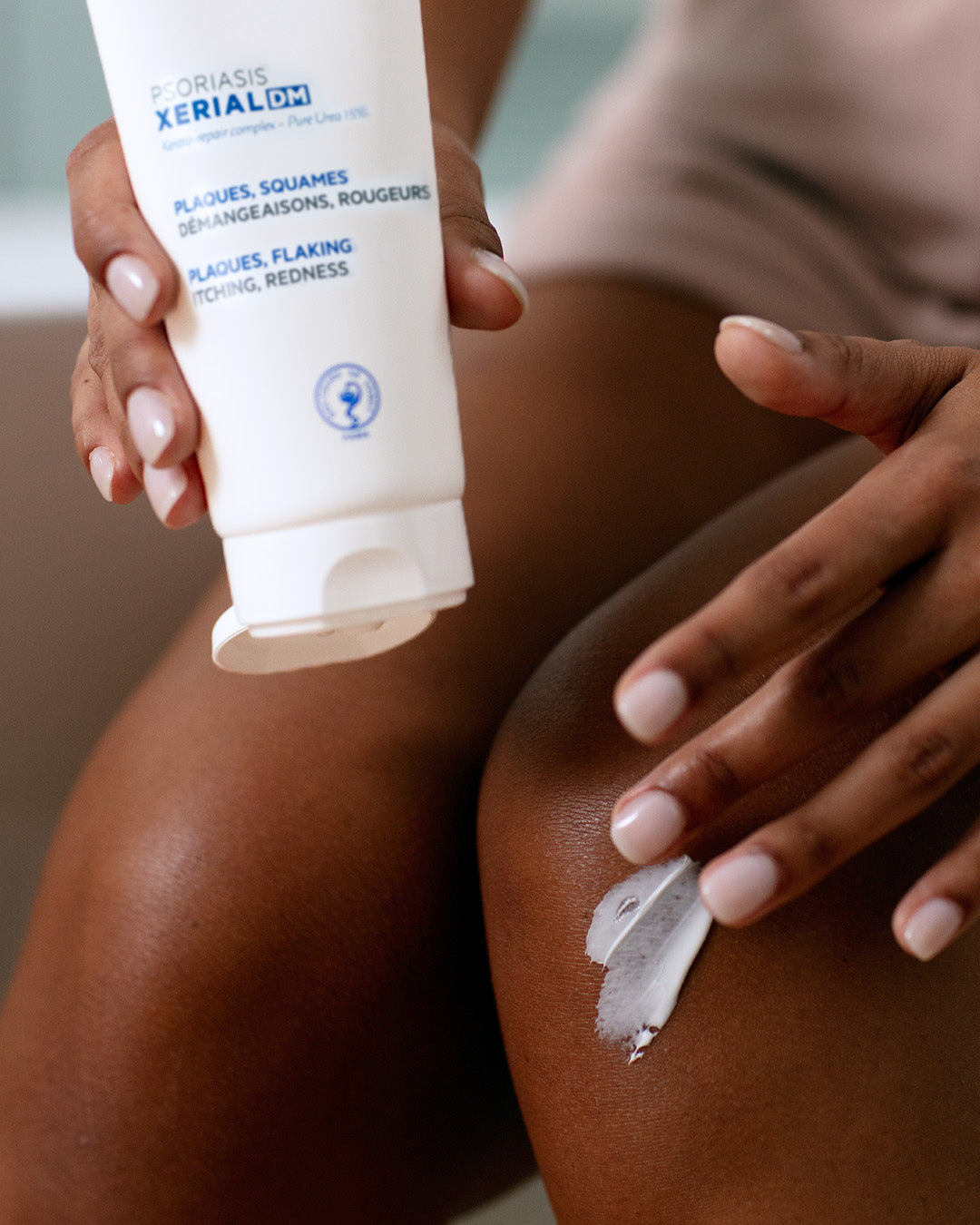

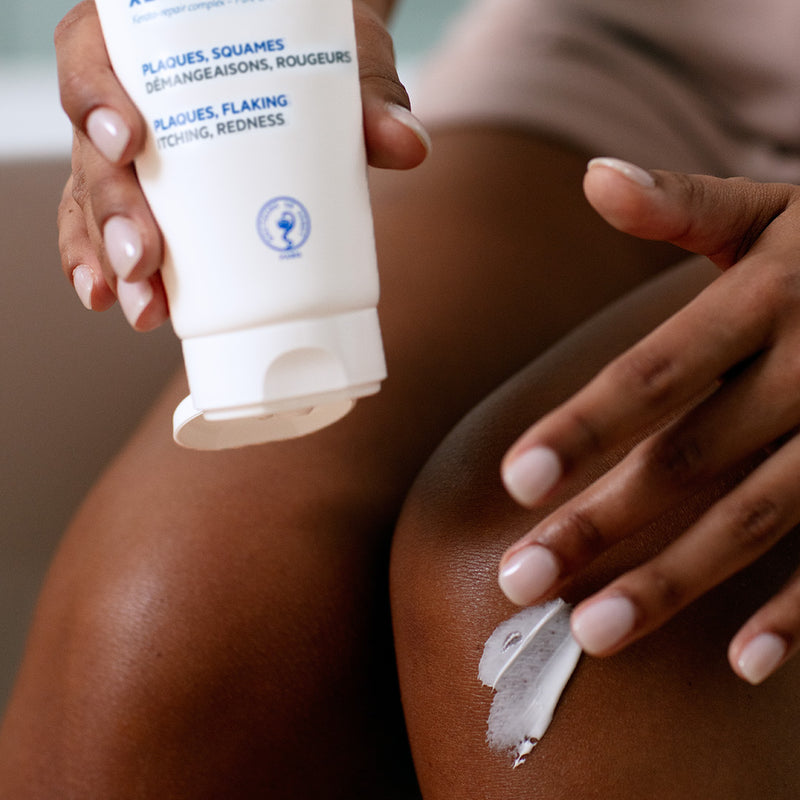
RÉSULTATS PROUVÉS
DÈS 14 JOURS
• -27% des squames2
APRÈS 30 JOURS
• -23% de rougeurs2
• +19% amélioration de la plaque (PSI score total)2
• 96% des patients ont trouvé que sa texture filmogène était facile à appliquer3
1- Mammone, T.; Gan, D.; Fthenakis, C.; Marenus, K. The Effect of N-Acetyl-Glucosamine on Stratum Corneum Desquamation and Water Content in Human Skin. J. Cosmet. Sci. 2009, 60, 423–428.
2- Investigation clinique multicentrique (centre 1 inactif), randomisée, en double aveugle et contrôlée par placebo sur 30 patients ayant 2 plaques de psoriasis (≈ 20 cm², espacées d’au moins 15 cm), en deux phases séparées avec application de XERIAL DM Psoriasis ou placebo deux fois par jour sur les plaques de psoriasis pendant 30 jours pour la phase 1 et pendant 28 jours pour la phase 2, séparée par un traitement à base de calcipotriol et de bétamétasone (un dermocorticoïde). Rapport d’évaluation clinique du 09/11/2021 n° 03-DM-2018 – n° ID-RCB 2018-A03297-48.
Évaluation du PSI score total et des sous-scores desquamation et rugosité à 14 et 30 jours (phase 1) :
PSI : n=30, moyenne (J0) = 7,50±1,22, moyenne (J14) = 6,10±1,75 (p <0.001) ; différence significative vs placebo ;
Desquamation : n=30, moyenne (J0) = 2,57±0,61, moyenne (J14) = 1,87±0,90 (p <0.001), différence significative vs placebo ;
Rougeurs : n=30, moyenne (J0) = 2,60±0,50, moyenne (J30) = 2,00±0,79 (p <0.001), différence significative vs placebo.
Résultats de tolérance : 42,4 % des patients ont présenté un total de 24 effets indésirables d’intensité légère à modérée dont 13 possiblement liés aux produits de l’étude : 9 liés à XERIAL DM Psoriasis et 4 au placebo. Ces effets sont les suivants : picotements (9 %), prurit (15 %) et sensation de brûlure (3 %). Tous les effets indésirables liés étaient locaux et ont été résolus avant la fin de l’étude.
3- Investigation clinique multicentrique (centre 1 inactif), randomisée, en double aveugle et contrôlée par placebo sur 30 patients ayant 2 plaques de psoriasis (≈ 20 cm², espacées d’au moins 15 cm), en deux phases séparées avec application de XERIAL DM Psoriasis ou placebo deux fois par jour sur les plaques de psoriasis pendant 30 jours pour la phase 1 et pendant 28 jours pour la phase 2, séparée par un traitement à base de calcipotriol et de bétamétasone (un dermocorticoïde). Rapport d’évaluation clinique du 09/11/2021 n° 03-DM-2018 – n° ID-RCB 2018-A03297-48. Autoévaluation à 7 jours (phase 2).
4- France Psoriasis.